水是一種極弱的電解質(zhì),能發(fā)生微弱的電離,其電離方程式為H2O===H++OH-。影響水的電離平衡的因素:溫度:升高溫度,促進(jìn)水的電離,Kw增大;降低溫度,抑制水的電離,Kw減小。溶液的酸堿性:向純水中加酸(或堿),使水溶液中c(H)或c(OH)增大,水的電離平衡逆向移動(dòng),抑制水的電離。

水是一種極弱的電解質(zhì),能發(fā)生微弱的電離,其電離方程式為
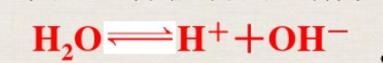
(1)溫度:升高溫度,促進(jìn)水的電離,Kw增大;降低溫度,抑制水的電離,Kw減小。
(2)溶液的酸堿性:向純水中加酸(或堿),使水溶液中c(H)或c(OH)增大,水的電離平衡逆向移動(dòng),抑制水的電離。
(3)鹽效應(yīng):向純水中加入含弱酸陰離子或弱堿陽(yáng)離子的鹽,水的電離平衡向電離方向移動(dòng),促進(jìn)水的電離。
(4)活潑金屬:與水電離出的氫離子反應(yīng),使氫離子濃度減小,促進(jìn)水的電離。
電離是吸熱的,吸熱的不多,一般溶解是吸熱的,可以近似是看成是電離的過程。
放熱的一般有:
化合反應(yīng),例如物質(zhì)的燃燒。
金屬和酸,和水反應(yīng),例如鈣,鈉等活潑金屬投入水中的反映。
酸堿中和反應(yīng)
吸熱一般有:
分解反應(yīng),比如實(shí)驗(yàn)室利用高錳酸鉀制氧氣,注意用詞,以上是一般,不是一定。
從微觀的角度出發(fā),如果反應(yīng)的過程中有化學(xué)鍵的合成的,那就是吸熱的,如果有化學(xué)鍵斷裂的,那就是放熱的。

高三,沒完沒了地做題、沒完沒了地考試,還有家長(zhǎng)和老師沒完沒了地嘮叨,加上自己給自己的壓力,很容易有急躁、郁悶、迷茫、懈怠等情緒。這個(gè)時(shí)候如果...

為了父母恩重,為了師生情長(zhǎng),我用青春的名義起誓,我要踏過書山坎坷!我要渡過學(xué)海茫茫!我要讓這天的自己勝過昨日的自己。我要用所有熱情換回時(shí)間,...

氧化物不都是電解質(zhì),但金屬氧化一般都是電解質(zhì),除個(gè)別非金屬氧化物外,一般都為非電解質(zhì)。氧化物屬于化合物(當(dāng)然也一定是純凈物)。其組成中只含兩...

可燃冰外形與冰相似,是甲烷水合物,可用化學(xué)式CH4?xH20表示;可燃冰燃燒的化學(xué)方程式為:CH4?8H2O+2O2=點(diǎn)燃=CO2+10H2...

高三經(jīng)過一輪復(fù)習(xí),成績(jī)開始倒退,考生們也開始懷疑自己是否真的做不到,其實(shí)并不是這樣的,大家首先要找自己是哪科退步了,退步的原因,是基礎(chǔ)不夠扎...


高三一輪復(fù)習(xí)要做好計(jì)劃,合理安排學(xué)習(xí)時(shí)間,提高做題效率,注重課堂學(xué)習(xí),跟著老師的思路走,你會(huì)發(fā)現(xiàn)自己受益頗多,一輪復(fù)習(xí)時(shí)要學(xué)會(huì)獨(dú)立做題,不要...

定義域是取交集。定義域指自變量x的取值范圍,是函數(shù)三要素(定義域、值域、對(duì)應(yīng)法則)之一,對(duì)應(yīng)法則的作用對(duì)象。求函數(shù)定義域主要包括三種題型:抽...