此試題可能存在亂碼情況,在查看時請點擊右上角全屏查看
2018年開封中考化學計算題專項訓練
1.侯氏制堿法的核心反應原理如下:
NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3
某溫度下,向溶質的質量分數為20%的氯化鈉溶液47.25 g中通入一定量氨氣(NH3)
和二氧化碳。充分反應后,將溶液中析出的碳酸氫鈉晶體過濾,低溫烘干,稱量,質
量為4.4 g。計算需要通入氨氣的質量。
(已知:該溫度下碳酸氫鈉飽和溶液中,碳酸氫鈉與水的質量比為1:9;且溶液中若存在其它溶質,不會對上述比值產![]() 生影響)。
生影響)。
2.據報道,在通入空氣并加熱的條件下,銅與稀硫酸反應轉化為硫酸銅。
![]() (1)請完成該反應的化學方程式:
(1)請完成該反應的化學方程式:
2Cu + 2H2SO4 + O2???? 2CuSO4 + ???
(2)某同學想利用此反應,將80 g含銅80%的廢料轉化為10%的硫酸銅溶液,計算需要加入10%的稀硫酸和水的質量(假設雜質不參加反應,也不溶于水)。
3.合成氨工業生產中所用催化劑的主要成分是FeO和Fe2O3,且FeO與Fe2O3的質量比為9∶20時,其催化活性最大。以Fe2O3為原料制備該催化劑時,可加入適量木炭粉,發生如下反應: 2Fe2O3+C ![]() 4FeO + CO2↑。試計算應向160g Fe2O3 粉末中加入的木炭粉質量。
4FeO + CO2↑。試計算應向160g Fe2O3 粉末中加入的木炭粉質量。
![E:\06—修圖軟件\新建文件夾\19 [轉換].jpg](http://img.chusan.com/upLoad/doc2017/6nbnl79t/164647.004.png) 4.實驗室用過量的稀鹽酸和大理石制取CO2,取50g反應后的濾液,逐滴滴入碳酸鈉溶液,測得滴入碳酸鈉溶液的質量與產生沉淀的質量關系如右圖所示。
4.實驗室用過量的稀鹽酸和大理石制取CO2,取50g反應后的濾液,逐滴滴入碳酸鈉溶液,測得滴入碳酸鈉溶液的質量與產生沉淀的質量關系如右圖所示。
(1)實驗中生成沉淀的最大質量是????? g。
(2)開始加入碳酸鈉溶液時,還沒有產生沉淀
的原因是?????????????????????????? ? 。
(3)計算原濾液中氯化鈣的質量分數。
(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)
5.某化工廠生產的純堿產品(含有少量氯化鈉)的包裝袋上注明:碳酸鈉≥96%。?
為了測定該產品中碳酸鈉的質量分數是否屬實,向4個分別盛有濃度相同、質量均為100 g稀鹽酸的燒杯中,分別放入不同質量的純堿產品,充分反應后,稱量燒杯中剩余物的質量,實驗數據如下表:
所稱量的物質 | 實驗1 | 實驗2 | 實驗3 | 實驗4 |
加入純堿產品質量/g | 2.8 | 5.6 | 11.2 | 14 |
燒杯中剩余物質量/g | 101.7 | 103.4 | 106.8 | 109.6 |
請計算(最后結果保留一位小數):
(1)該純堿產品中碳酸鈉質量分數的標注![]() 是否真實。
是否真實。
(2)所用鹽酸溶液中溶質的質量分數。
(3)恰好完全反應時,所得溶液中溶質的質量分數。
6.過氧化氫的水溶液俗稱雙氧水,在放置過程中會緩慢分解。現有一瓶未曾使用過的、久置的雙氧水,瓶上商品標簽提供了如下信息:??
①H2O2的質量分數為30%; ②內裝溶液質量1 000 g。
經實驗測定,其中H2O2的質量分數現僅為10%。 請計算: 新-課 -標-第-一- 網
(1)若用這瓶雙氧水來配制3%的醫用雙氧水1500 g,需用這種雙氧水的質量是多少?
(2)計算這瓶雙氧水中已分解的過氧化氫的質量。
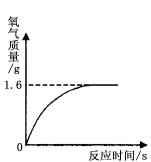 7.過氧化氫溶液在存放過程中會自然分解,使溶質質量分數減小。某同學使用一瓶原標注為30%的過氧化氫溶液完成制取氧氣的實驗。通過稱量,該瓶中共有116.8 g溶液,取出13.6 g在一定條件下進行實驗,發現生成氣體的質量與反應時間的關系如右圖所示。試計算
7.過氧化氫溶液在存放過程中會自然分解,使溶質質量分數減小。某同學使用一瓶原標注為30%的過氧化氫溶液完成制取氧氣的實驗。通過稱量,該瓶中共有116.8 g溶液,取出13.6 g在一定條件下進行實驗,發現生成氣體的質量與反應時間的關系如右圖所示。試計算
⑴現在這瓶過氧化氫溶液的溶質質量分數。
⑵該瓶溶液中,已經分解的過氧化氫質量。
8.鹽水選種是我國古代勞動人民發明的一種巧妙的挑選種子的方法。農業生產上常用溶質質量分數為15%-20%的氯化鈉溶液來選種。
(1)要配置150kg16%的氯化鈉溶液,計算應稱取氯化鈉的質量。
(2)選種進行一段時間后,農技員估計溶液和溶質質量分數都有所減少,他取出50g氯化鈉溶液,加入過量AgNO3溶液,得到沉淀14.35g,計算氯化鈉溶液中溶質的質量分數。
(反應原理為:AgNO3+ NaCl = AgCl↓+NaNO3)
(3)若此時氯化鈉溶液的質量只剩下100kg,要使溶液質量和溶質質量分數都恢復到(1)中的狀態,計算需要加入的氯化鈉和水的質量。
9.鹽堿湖中撈出來的純堿中含有一定量的食鹽,為測定其中碳酸鈉的含量,化學小組的同學將某純堿樣品24.6g放入燒杯中,逐滴加入150g稀鹽酸,恰好完全反應,待不再產生氣泡時,得到168g的食鹽溶液。計算原混合物中碳酸鈉的質量分數和反應后溶液的溶質質量分數(CO2的溶解忽略不計)。
![]() 10.在電纜生產過程中會產生一定量的含銅廢料。據報道,在通入空氣并加熱的條件下,銅與稀硫酸反應轉化為硫酸銅,該反應的化學方程式為:
10.在電纜生產過程中會產生一定量的含銅廢料。據報道,在通入空氣并加熱的條件下,銅與稀硫酸反應轉化為硫酸銅,該反應的化學方程式為:
2Cu + 2H2SO4 + O2?????? 2CuSO4 +2H2O。若用一定量溶質的質量分數為9.8%的稀硫酸恰好處理2000g含銅3.2%的廢料(假設其他雜質不和硫酸反應且不溶于水),求反應后所得硫酸銅溶液中溶質的質量分數。
11.由醋酸溶液和醋酸鈉溶液混合而成的緩沖溶液(其中醋酸的質量分數為2.5%)在農業上常用于土壤分析、農用微生物的培育等。某同學用5%的醋酸溶液和400 g10%的氫氧化鈉溶液混合配制該緩沖溶液,所需醋酸溶液的質量為多少克?(資料:反應的化學方程式為:NaOH + CH3COOH = CH3COONa + H2O)
12.現有Cu與另一種金屬(可能是Mg、Fe、Zn中的一種)形成的粉末。現欲測定其組成,進行如下實驗:取該粉末16g放入燒杯,將溶質質量分數為14%的稀硫酸280.0g分4次加入該燒杯中,充分反應后,測得剩余的固體質量數據記錄如下:
次數 | 1 | 2 | 3 | 4 |
加入稀硫酸質量/g | 70.0 | 70.0 | 70.0 | 70.0 |
剩余固體質量/g | 13.6 | 11.2 | 8.8 | 8.4 |
計算(要求寫出計算過程):
(1)該粉末中Cu的質量分數。
(2)該粉末中另一種金屬為何種金屬。
(3)第3次加入稀硫酸充分反應后,所得溶液中溶質的質量分數。
2018年開封中考化學計算題專項訓練參考答案
1.(3分)1.7 g
給分點參考如下:
(1)利用1:9建立溶質與溶劑質量關系????????????????????????????? 1分
(2)能找出反應中NH3、H2O、NaHCO3質量關系????????????????????? 1分
(3)求出氨氣的質量為1.7 g??????????????????????????????????????? 1分
???? ![]() 解題過程參考如下:
解題過程參考如下:
【解】設:需要氨氣的質量為![]() 。
。
NH3 + CO2 +? NaCl?? + H2O? ==== NH4Cl +?? NaHCO3?????????????
17?????? ?????????????????? 18?????????????????????? 84
??????? ![]() ????????????????????????
???????????????????????? ![]() ?????????????????????
????????????????????? ![]() ? 1分
? 1分
?????????????  =
= ![]()
![]() 2.(3分)
2.(3分)
(1)2H2O
(2)解:設生成硫酸銅的質量為x,生成水的質量y,消耗H2SO4的質量為z。
2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O??
128??? 196????????? 320???? 36
?? 80g×80%? z??????????? x?????? y????????????????????????????????
![]()
![]()
![]()
![]()
![]()
![]()
![]() ??? —— = —— = —— = ——
??? —— = —— = —— = ——
![]()
![]() ? =160 g?? y =18 g?? z = 98 g?
? =160 g?? y =18 g?? z = 98 g?
![]() 稀硫酸溶液的質量=????? = 980 g?????????????? ???? ?? … ……………… (1分)
稀硫酸溶液的質量=????? = 980 g?????????????? ???? ?? … ……………… (1分)
硫酸銅溶液的質量=????? = 1600 g?????
加入水的質量= 1600 g―160 g―18 g―980 g×90% = 540 g?? …………? (1分)
?? 答:略。
3.解:設生成FeO的質量為x;需加入木炭粉的質量是y。
2Fe2O3 + C ![]() 4FeO十CO2↑
4FeO十CO2↑
320??? 12??????? 288
?????? y???????? x???????????????????????????????????????????
反應后剩余Fe2O3的質量為:![]()
參加反應Fe2O3的質量為:160 g- ![]() ??????????? ……………………1分????????????????????????????
??????????? ……………………1分????????????????????????????
則列式:? ![]()
解得:x=48g??????????????????????????????? ……………………1分
列式:![]() =
= ![]() ????????????????????????
????????????????????????
解得:y=2 g???????????????????????????
答:需加入木炭粉2 g???
4.(1)5??? ·········································1分
(2)稀鹽酸先與碳酸鈉反應? ·································1分
(3)解:設原濾液中CaCl2的質量為x
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl??
?????????????? 111?? 100
![]()
![]() ??????????????? x???? 5g
??????????????? x???? 5g
x=????????????????
![]() ????????????????
????????????????
原濾液中CaCl2的質量分數=???????????????? ????? ·················1分
答:原濾液中氯化鈣的質量分數是11.1%。
5.【解】鹽酸完全反應時,生成二氧化碳的質量為100 g﹢11.2 g﹣106.8 g﹦4.4 g。
設:純堿產品中碳酸鈉質量為x,稀鹽酸中溶質的質量為y,生成氯化鈉的質量為z。
???????????????? Na2CO3 + 2HCl ???? 2NaCl + H2O + CO2↑
?? 106???? 73??????? 117???????? 44
?????????????????????? x ???? y???????? z????????? 4.4 g
x = 10.6 g????? y = 7.3 g??????? z = 11.7 g
(1)純堿產品中碳酸鈉的質量分數![]() ???? 標注不真實。
???? 標注不真實。
??????? (2)鹽酸溶液中溶質質量分數![]()
(3)氯化鈉溶液中溶質質量分數![]()
6.設所需這種雙氧水的質量為x, 則x×10%=1 500 g×3%, X=450g? --------1分
(2) 設這瓶雙氧水變質過程中減少的過氧化氫的質量為y
2H2O2MnO22H2O+O2↑
68?????????? 32
y???????????? 32/68Y
余下溶質H2O2的質量為300g-y,余下溶液的質量為1000g-32/68Y。
再根據變質后溶液中溶質的質量分數為10%列出長等式:
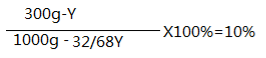 ----------------1分
----------------1分
求出y=209.9----------------1分
![]() 7.解:⑴設13.6 g過氧化氫溶液中溶質的質量為x。
7.解:⑴設13.6 g過氧化氫溶液中溶質的質量為x。
?? 2H2O2 ?????? 2H2O + O2↑????????????????
???? 68?????????????? 32
x?????????????? 1.6 g??????????????????????
![]() ?????????????? x=3.4g?
?????????????? x=3.4g?
該溶液中溶質的質量分數= ![]() ……………………(1分)
……………………(1分)
![]() ⑵設已分解的過氧化氫的質量為y ,產生氧氣的質量為z。
⑵設已分解的過氧化氫的質量為y ,產生氧氣的質量為z。
2H2O2 ?????? 2H2O + O2↑
????? 68??????????????? 32
y???????????????? z
![]() z =
z =![]()
???????? ??????? [y+116.8g×25%]/(116.8+![]() )=30%
)=30%
y+29.2=35.04+9.6/68 y
![]() 58.4/68y=5.84
58.4/68y=5.84
y=6.8g
答略
8.解:(1)150kg×16%=24 kg --------------(1)
(2)? 設生成氯化鈉的質量為X
AgNO3+ NaCl = AgCl↓+NaNO3
???????????? 58.5?? 143.5
???????????? X???? 14.35g
????? 58.5 :143.5 = X :14.35 g????????
X =5.85 g
(5.85/50)×100%=11.7%------------(1)
需要加入氯化鈉的質量為:24 kg﹣100 kg×11.7%=12.3 kg
需要加入水的質量為:150 kg﹣100 kg﹣12.3 kg=37.7 kg??? ![]() ------------(1)
------------(1)
9.設: 原混合物中碳酸鈉的質量為X ,生成氯化鈉的質量為Y,生成二氧化碳的質量為z。
Na2CO3? +? 2HCl =? 2NaCl + H2O + CO2↑
106??????????????? 117???????? 44
???? X???????????????? Y?????????? 6.6g
???? ![]() ????
???? ![]()
X=15.9g??? Y=17.6g
10.2000g×3.2%=64 g
設需硫酸的質量為x,參加反應氧氣的質量為y, 生成硫酸銅的質量為z
![]()
2Cu + 2H2SO4 + O2?????? 2CuSO4 +2H2O
? 128?? 196???? 32??????? 320
?? 64 g?? x????? y???????? z
![]()
![]() =
=![]() =
=![]() =
=![]() ???????????????
???????????????
![]() ? x=98 g? y=16 g? z =160 g
? x=98 g? y=16 g? z =160 g
?? 98 g÷9.8%=1000g
![]() ?
? ![]() ×100%=14.8%
×100%=14.8%
答:反應后所得硫酸銅溶液中溶質的質量分數為14.8%。
11.解:設:40![]() 0 g10%的氫氧化鈉溶液和醋酸溶液反應,消耗的醋酸的質量為X
0 g10%的氫氧化鈉溶液和醋酸溶液反應,消耗的醋酸的質量為X
NaOH + CH3COOH=CH3COONa + H2O
![]() ??????? 400 g×10%??? X
??????? 400 g×10%??? X
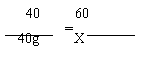 ????????? = 40g
????????? = 40g
???????????????????????????????? X = 60g
設:反應后溶液中醋酸的質量為Y
![]()
![]() ??????????? Y÷2.5% = (60g + Y) ÷5% + 400 g
??????????? Y÷2.5% = (60g + Y) ÷5% + 400 g
![]() ????????????????? Y = 80g[來源:學。科。網]
????????????????? Y = 80g[來源:學。科。網]
12.(1)該粉末中Cu的質量分數為![]() ……………………(1分)
……………………(1分)
(2)[解]設:另一種金屬為M,其相對分子質量為x
???????? 分析表格中數據可知每70g稀硫酸與2.4g金屬M恰好完全反應
?????????? ![]() ?? M? +? H2SO4? ===? MSO4? +? H2↑
?? M? +? H2SO4? ===? MSO4? +? H2↑
?? ![]() ?????
????? ![]() ???? x??????? 98
???? x??????? 98
???????????? 2.4g???? ![]()
??????????? x = 24????
該金屬為鎂????????? ……………………………………………… (1分)
(3)[解]第3次加入稀硫酸充分反應后,消耗金屬鎂的質量為7.2g。
設:此時生成MgSO4 的質量為y,生成 H2的質量為z
??????????? M g? +? H2SO4? ===? MgSO4? +? H2↑
???????? 24?????? ![]() ??????????? 120?????? 2
??????????? 120?????? 2
7.2g?????????????????? y??????? z
????????? ![]() ?????????? y = 36 g
?????????? y = 36 g
????????? ![]() ??????????? z = 0.6 g
??????????? z = 0.6 g
?????? 則此時所得溶液中溶質質量分數為![]() ?? (1分)
?? (1分)
??????? 答:略

孔乙己是貧困潦倒的知識分子。在書中,孔乙己是一個知識分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產生氧氣的化學方程式:光合作用的反應式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應和暗反應兩個過程。需要具備光...

有的高校沒有條件,只要學業水平成績都合格就可以,比如中國科學院大學。有的需要平常學習考試成績,比如北京外國語大學要求高三第一學期期末成績在全...

在四則運算中,表示計算順序,在小括號之后、大括號之前;表示兩個整數的最小公倍數;表示取未知數的整數部分;在函數中,表示函數的閉區間;在線性代...

濟南開設的最好的職高學校有:濟南方信集團職業高中、濟南公共交通職業高中。濟南市公共交通職業高級中學是由濟南市公共交通總公司承辦,業務屬濟南市...

實然:是說事物實際上就是這樣的,但不同于現實性(現實性指其有合理性和客觀性);應然:就是應該是怎么樣的意思,比如說這件事,就應該是那樣的結果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風帶控制,鋒面氣旋頻繁活動,氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...