2018年吉林省東北師大附屬中學化學模擬題(精編word版)
為了方便您的閱讀請點擊全屏查看
第I卷(共50分)
單項選擇題(每小題2分,共20分)
下列![]() 物質的分類組合全部正確的是
物質的分類組合全部正確的是
編號 | 強電解質 | 弱電解質 | 非電解質 |
A[來源:學,科,網] | CaCO3 | ? HF | CI2 |
B | ? NaHCO3 | H2S | ? CH3COOH |
C | Ba(OH)2 | HCI | ? Cu |
D | FeCI3 | NH3H2O | ? CCI4 |
![]() 反應C(s)+H2O(g)? CO(g)+H2(g)在密封容器中進行,下列條件的改變對其反應速率幾乎無影響的是
反應C(s)+H2O(g)? CO(g)+H2(g)在密封容器中進行,下列條件的改變對其反應速率幾乎無影響的是
①增加C的量? ②將容器的體積縮小一半③保持體積不變,充入N2使體系壓強增大. ④保持壓強不變,充入N2能使容器體積變大
①④? B.②③ C.①③D.②④
下列有關溶液酸堿性的說法正確的是
c(H)=C(OH)的溶液顯中性
堿性溶液中,c(H+)小于1.0×10-7mol-L-1
當溶液呈酸性時![]() ,水電離的c(H+)>c(OH)
,水電離的c(H+)>c(OH)
在100°C時,純水的PH<7,因此顯酸性
下列利用相關數據作出的推理或判斷正確的是
只利用焓變數據即可判斷反應能否自發進行
利用溶液的PH即可判斷溶液的酸堿性
可利用反應熱數據判斷反應速率的大小
可利用平衡常數判斷反應進行的程度大小
![]()
![]() 已知人體體液中存在如下平衡:H+HCO3 H2CO CO2H2O.以維持體液
已知人體體液中存在如下平衡:H+HCO3 H2CO CO2H2O.以維持體液![]() 的PH的相對穩定。下列說法中不合理的是
的PH的相對穩定。下列說法中不合理的是
A.強酸性物質進入體液后,上述平衡向右移動,以維持體液的pH的相對穩定
B.當強堿性物質進入體液后,上述平衡向左移動,以維持體液的pH的相對穩定
C.進行呼吸活動時,如CO2進入血液,會使體液的pH減小
D.若靜脈滴注大量生理鹽水,則體液的pH減小
![]() 在一定溫度下,反應A2(g)+B2(g) 2AB(g)達到平衡的標志是
在一定溫度下,反應A2(g)+B2(g) 2AB(g)達到平衡的標志是
A.c(A2![]() ): c(B2):c(AB)=1:1:2
): c(B2):c(AB)=1:1:2
B.容器內的總壓不隨時間的變化而變化
C.單位時間內生成2nmolAB同時生成nmolB2
D.單位時間內生成nm![]() olA2同時生成nmolB2[來源:]
olA2同時生成nmolB2[來源:]
7.0.6molX氣體和0.4mol氣體混合欲2L的密封容器中,發生如下反應:3X(g)+Y(g)=nZ(g)+2W(g).5min末生成0.2molW,若測知以Z濃度變化表示的平均反應速率為0.01mol/L?min,則n的值為()
A.2? B.4 C.1 D.3
![]()
![]() 8.已知下列反應的平衡常數: H2(g)+S(s)? H2S(g) K1 S(s)+O2(g)SO2(g) .K2 則反應H2(g)+SO2(g)? O2+H2S(g)的平衡常數為
8.已知下列反應的平衡常數: H2(g)+S(s)? H2S(g) K1 S(s)+O2(g)SO2(g) .K2 則反應H2(g)+SO2(g)? O2+H2S(g)的平衡常數為
A.K1+K2 B.K1-K2? C.K1×K2? D.K1/K3
![]() 9.在密封容器中進行發生如下反應:X2(g)+Y2(g) 2Z(g)已知X2Y2、2的起始濃度分別為0.1mol/L 、0.3mol/L、0.2mol/L在一定的條件下,當反應達到平衡時,各物質的濃度有可能是
9.在密封容器中進行發生如下反應:X2(g)+Y2(g) 2Z(g)已知X2Y2、2的起始濃度分別為0.1mol/L 、0.3mol/L、0.2mol/L在一定的條件下,當反應達到平衡時,各物質的濃度有可能是
A.Z為0.3mol/L B. Y2為0.35mol/L C. X2為0.2mol/L? D. Z為0.4mol/L[來源:.Com]
![]() 10.一定量混合氣體在密封容器中發生如下反應:xA(g)+yB(g) nC(g).達到平衡后測得A氣體的濃度為0.5 mol/L;保持恒溫下將密閉容器的容積擴大1倍,,再達到平衡時,測得A的濃度為0.3 mol/L。則下列敘述正確的是
10.一定量混合氣體在密封容器中發生如下反應:xA(g)+yB(g) nC(g).達到平衡后測得A氣體的濃度為0.5 mol/L;保持恒溫下將密閉容器的容積擴大1倍,,再達到平衡時,測得A的濃度為0.3 mol/L。則下列敘述正確的是
A.x+y<nB.該化學平衡向右移動C.B的轉化率增大 D.A的物質的量增加
二、單項選擇(每小題3分,共30分)
11.高氯酸、硫酸、硝酸和鹽酸都是強酸,其酸性在水溶液中差別不大,四種物質在冰醋酸中的電離常數如下:
| HCIO4 | H2SO4 | HCI | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下說法不正確的是
A.在冰醋酸中高氯酸是這四種酸中最強的酸
B.在冰醋酸中這四種酸都沒有完全電離
C.在冰醋酸中硫酸的電離方程式為H2SO4=2H++SO![]()
D.酸的強弱![]() 與其本身的結構和溶質的性質有關
與其本身的結構和溶質的性質有關
12.X、Y、Z三中氣體,取X和Y按.取X和Y按1:1的物質的量之比混合,放入密閉容器中發生如下反應:X+2Y2Z ,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3:2,則Y的轉化率最接近于( )
A.33%? B.40%C.50%D.65%
13.已知室溫時.0.1mol/L,是某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是
A![]() .該溶液中PH=3
.該溶液中PH=3
B.升高溫度時,溶液的PH減小
C.此酸的電離平衡常數為1×10-7
D.由HA電離出的c(H+)約為水電離出的c(H+)的 106倍。
要證明某一元酸是弱酸,下列方法正確的是
A.將串聯一小燈泡的該酸溶液與串聯一相同小燈泡的硫酸并聯,接通電源后,若該溶液上的燈泡較暗,則說明該酸是弱酸
B .測定0.01mol/L該酸溶液常溫下的PH,若PH>2,則說明該酸是弱酸
C .用該酸與金屬鋅反應,產生氣泡較慢,則說明該酸是弱酸
D.中和等體積等,濃度的NAOH溶液消耗該酸的體積小消耗鹽酸的體積,則說明該酸是弱酸
![]() 15.已知甲為恒溫恒壓容器,乙為恒溫恒容容器。兩容器中均充入2molSO2、1molO2,發生反應:2SO2(g)+O2(g) 2SO3(g).△H<0.初始時兩容器的溫度、體積相同。一段時間后兩容器中反應均達到平衡,為使兩容器中SO2在平衡混合物中的物質的量分數相同,下列措施中可行的是
15.已知甲為恒溫恒壓容器,乙為恒溫恒容容器。兩容器中均充入2molSO2、1molO2,發生反應:2SO2(g)+O2(g) 2SO3(g).△H<0.初始時兩容器的溫度、體積相同。一段時間后兩容器中反應均達到平衡,為使兩容器中SO2在平衡混合物中的物質的量分數相同,下列措施中可行的是
A.向乙容器中充入一定量的SO3氣體B.向甲容器中充入一定量的氦氣
C.升高乙容器的溫度D.增大甲容器的壓強
下面是某化學研究小組探究外界條件對化學反應速率![]() 和化學平衡影響的圖像其中圖象和實驗結論表達正確的是
和化學平衡影響的圖像其中圖象和實驗結論表達正確的是
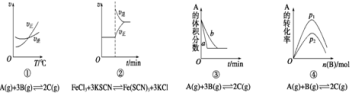
A.①是其他條件一定時,反應速率隨溫度變化的圖象,正反應△H>0
B.②是在平衡體系的溶液中溶入少量KCl晶體后化學反應速率隨時間變化的圖象
C.③是在有無催化劑存在下建立的平衡過程圖象,B 是使用催化劑時的曲線
D.④是一定條件下,向含有一定量A的容器中逐漸加入B時的圖象,壓強p1>p2
![]() 17.向密閉容器中,按n(CO):n(H2)=1:2充入反應物,發生反應:CO(g)+2H2(g)CH3OH(g)? △H<0。L(L1、L2)、X可分別代表壓強或溫度,下圖表示L一定時,平衡混合物中CH3OH的體積分數隨X的變化關系。下列說法中,正確的是( )
17.向密閉容器中,按n(CO):n(H2)=1:2充入反應物,發生反應:CO(g)+2H2(g)CH3OH(g)? △H<0。L(L1、L2)、X可分別代表壓強或溫度,下圖表示L一定時,平衡混合物中CH3OH的體積分數隨X的變化關系。下列說法中,正確的是( )
A.X代表壓強? B.L1 <L2[來源:學|科|網]
C.平衡常數:K(A)=K(B)? D.在C點時,CO轉化率為75%

![]() 18.工業上,利用CO和H2合成二甲醛:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)。為了尋找合適的溫度,研究者進行了多次實驗,每次實驗保持原料氣組成(3molCO、3molH2)、體積(10L)、反應時間等因素不變,實驗結果如圖所示.下列說法正確的是
18.工業上,利用CO和H2合成二甲醛:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)。為了尋找合適的溫度,研究者進行了多次實驗,每次實驗保持原料氣組成(3molCO、3molH2)、體積(10L)、反應時間等因素不變,實驗結果如圖所示.下列說法正確的是
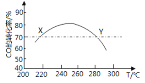
A.X、Y兩點對應的CO正反應速率相等
B.合成二甲醚的正反應△H>0
C.反應溫度應控制在240℃~260℃之間
D.選擇合適催化劑,可以提高CO轉化率
19.已知反應2N2O5(g)4N![]() O2(g)+O2(
O2(g)+O2(![]() g)的分解速率表達式為v正=k正.cm(N2O5),k正是與溫度有關的常數,340K時實驗測得的有關數據如下
g)的分解速率表達式為v正=k正.cm(N2O5),k正是與溫度有關的常數,340K時實驗測得的有關數據如下![]() :
:
t/min12? 3? 4
c(N2O5)(mol/L)-10.133 0.080 0.057? 0.040
V正mol/L-1·min-10.04660.028 0.020? 0.014
下列有關敘述不正確的是
A.340K時,速率表達式中m=1
B.340K時,速率表達式中k正 ≈0.35min-1
C.340K時,若c(N2O5)=0.100mol/L+1,則v正 ≈0.035mol/L-1·min
D.若t=2min時升高溫度,則m不變,k正減小
20.反應aM(g)+bN(g)cP![]() (g)+dO(g)達到化學平衡時,M的體積分數y(M)與反應條件的關系如下圖所示.其中:Z表示反應開始時N的物質的量與M的物質的量之比.下列說法正確的是
(g)+dO(g)達到化學平衡時,M的體積分數y(M)與反應條件的關系如下圖所示.其中:Z表示反應開始時N的物質的量與M的物質的量之比.下列說法正確的是
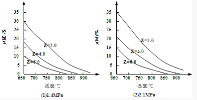
A.同溫同壓同Z時,加入催化劑,達到化學平衡時Q的體積分數一定增加
B.同溫同壓時,增加Z,達到化學平衡時Q的體積分數一定增加
C.同溫同Z時,增加壓強,達到化學平衡時Q的體積分數一定增加
D.同壓同Z時,升高溫度,達到化學平衡時Q的體積分數一定增加
第Ⅱ卷(共50分)
三、填空題(本題有3小題,共50分)
(10分)化學反應速率是描述化學反應進行快慢程度的物理量。為探討化學反應速率的影響因素,某同學設計的實驗方案如下:(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
實驗 序號 | 體積V/mL | 時間/s
| |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
該實驗進行的目的是;
淀粉溶液的作用是? 。
(2)表中Vx=__________mL,t1、t2、t3由大到小順序為__;試推測該實驗結論:? 。
22.(16分)25℃時,部分物質的電離平衡常數如下表示:
化學式 | HA | H2B | HC |
電離平衡常數 | 1.7×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8
|
請回答下列問題:
HA、H2B、HC的酸性由強到弱的順序為
? 。
(2)同濃度A、HB-、B2+、C結合H+的能力由強到弱的順序。
(3)常溫下,0.1mol?L-1的HA溶液加水稀釋過程中,下列表達式的數據一定變小的是______(填字母序號,下同)
A.c(H+) ![]() B.c(H+)/c(HA)? C.c(H+)?c(OH- )D.c(OH-)/c(H+)
B.c(H+)/c(HA)? C.c(H+)?c(OH- )D.c(OH-)/c(H+)
若該溶液升高溫度,上述4種表達式得數據增大的是。
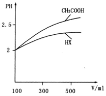
體積均為10mL pH=2的HA與一元酸HX分別加水稀釋至1000mL,稀釋過程中pH變化如圖所示,則HX的電離平衡常數______(填“大于”、“小于”或“等于”)HA的電離平衡常數.理由是:______.稀釋后,HX溶液中由水![]() 電離出來的c(H-)? (填“大于”、“小于”或“等于”)HA溶液中由水電離出來的c(H+),理由是
電離出來的c(H-)? (填“大于”、“小于”或“等于”)HA溶液中由水電離出來的c(H+),理由是
23.(24分)化學反應原理在科研和生產中有廣泛應用。
Ⅰ.利用“化學蒸氣轉移法”制備TaS2晶體,發生如下![]() 反應:
反應:
TaS2(s)+2I2(g)TaI4(g)+S2(g)
該反應的平衡常數表達式K= .
某溫度時,向某恒容密閉容器中加入1mol I2(g)和足量TaS2(s),若I2(g)的平衡轉化率為80%,此溫度時該反應的K值為 。
在此溫度下,向另一恒容容器中加入等質量I2(g)、TaI4(g)、S2(g)和足量的TaS2(s),此時r(正)r(逆) (填“大于”、“等于”或“小于”):平衡時 I2(g)的體積百分含量為 。
Ⅱ.制備甲醇反應如下:CO(g)+2H2(g) CH3OH(g)
甲圖是反應時CO和CH3OH(g)的濃度隨時間t的變化情況。從反應開始到達平衡,用H2表示平均反應速率υ(H2)=。
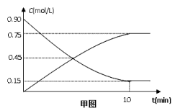 ?
? 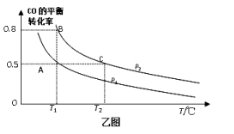
(5)在一容積可變的密閉容器中充入10 mol CO和20 mol H2,CO的平衡轉化率隨溫度(T)、壓強(P)的變化如乙圖所示。
①下列說法不能判斷該反應達到化學平衡狀態的是_____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的體積分數不再改變
C.體系中H2的轉化率和CO的轉化率相等
D.體系中氣體的平均摩爾質量不再改變
②比較A、B、C三點化學反應速率由大到小順序是______。
③若達到化學平衡狀態A時,容器的體積為20 L。如果反應開始時仍充入10 molCO和20 molH2,則在平衡狀態B時容器的體積V(B)=___________L。

孔乙己是貧困潦倒的知識分子。在書中,孔乙己是一個知識分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產生氧氣的化學方程式:光合作用的反應式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應和暗反應兩個過程。需要具備光...

有的高校沒有條件,只要學業水平成績都合格就可以,比如中國科學院大學。有的需要平常學習考試成績,比如北京外國語大學要求高三第一學期期末成績在全...

在四則運算中,表示計算順序,在小括號之后、大括號之前;表示兩個整數的最小公倍數;表示取未知數的整數部分;在函數中,表示函數的閉區間;在線性代...

濟南開設的最好的職高學校有:濟南方信集團職業高中、濟南公共交通職業高中。濟南市公共交通職業高級中學是由濟南市公共交通總公司承辦,業務屬濟南市...

實然:是說事物實際上就是這樣的,但不同于現實性(現實性指其有合理性和客觀性);應然:就是應該是怎么樣的意思,比如說這件事,就應該是那樣的結果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風帶控制,鋒面氣旋頻繁活動,氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...